domingo, 24 de abril de 2016
lunes, 14 de marzo de 2016
Modelo Atómico de Niels Bohr
Antecedentes del modelo atómico de Bohr.
Energía Radiante.
Para comprender la teoría cuántica de Planck
es necesario tener cierto conocimiento acerca de la naturaleza de las ondas.
Podemos pensar en una onda como una alteración vibrátil mediante la cual se
transmite la energía. Las propiedades básicas de una onda se ilustran con un
tipo muy conocido de ondas: las del agua. La variación regular de las crestas y
los valles hace posible percibir la propagación de las ondas.
Las propiedades características
de las ondas son su longitud y altura, así como el número de andas que pasan
por determinado punto en un segundo. La longitud
de onda
(lambda) es
la longitud entre puntos iguales de ondas sucesivas. La frecuencia
(nu), es el número de ondas que pasan por un
punto particular en un segundo. La amplitud de la onda es la longitud
vertical de la línea media de una onda a su cresta o a su valle. La rapidez es
otra de las propiedades importantes de una onda, que depende del tipo de onda y
del medio en el cual viaja (por ejemplo, agua, aire o vacío). La rapidez (u) de
una onda es el producto de su longitud y frecuencia:
Existen
muchos tipos ondas, como las del agua, del sonido y de la luz, en 1873, James
Clerk Maxwell propuso que la luz visible se compone de ondas electromagnéticas.
De acuerdo con esta teoría, una onda electromagnética tiene un componente de
campo eléctrico y un componente de campo magnético. Ambos tienen la misma
longitud de onda y frecuencia, y por tanto, igual rapidez, pero viajan en
planos perpendiculares entre sí. La trascendencia de la teoría de Maxwell
estriba en que aporta una descripción matemática del comportamiento general de
la luz. En particular, el modelo de Maxwell describe con exactitud cómo se
puede propagar la energía en forma de radiación a través del espacio como una
vibración de campo magnético y eléctrico. La radiación electromagnética es
la emisión y transmisión de energía
en forma de ondas electromagnéticas.
Las ondas electromagnéticas
viajan a 3.00 x 10 8 metros por segundo. Esta rapidez varía según el
medio, pero no lo suficiente para modificar de manera sustancial los cálculos.
Por convención, la rapidez de las ondas electromagnéticas, que comúnmente se
llama rapidez de la luz, se expresa con el símbolo c. la longitud de onda de las ondas electromagnéticas se expresa
normalmente en nanómetros (nm).
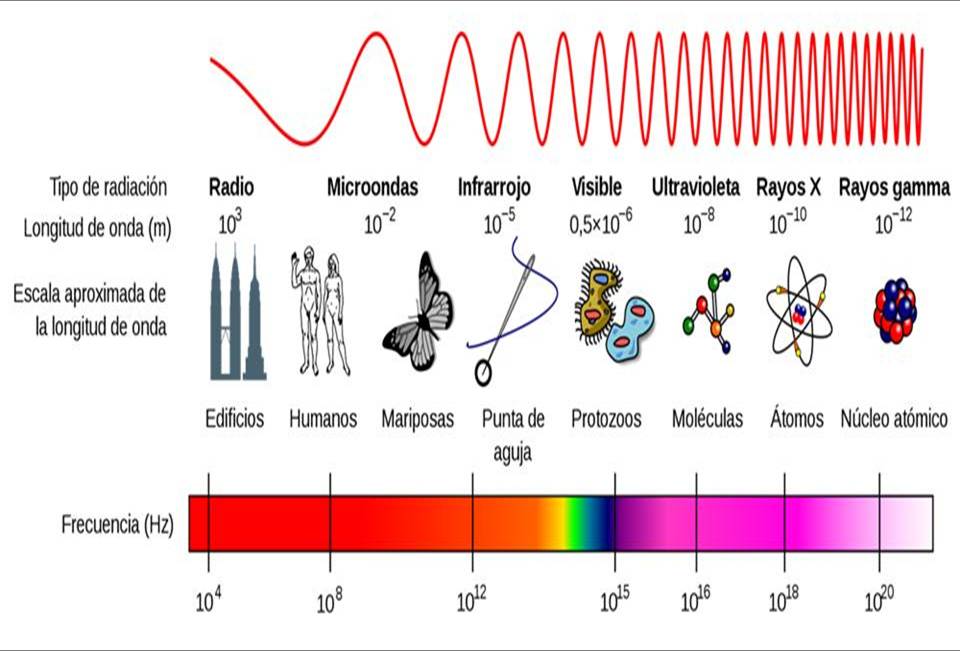
A continuación presentamos los distintos rangos de fotones que contiene
el espectro electromagnético: Los fotones con más energía que se conocen son
los Fotones gamma, son aquellos
asociados a las longitudes de onda más corta y son llamados rayos gamma. Si se
sigue incrementando la longitud de onda, continúan los rayos x, y luego los
rayos ultravioleta.
Si seguimos aumentando la
longitud de onda pasamos a la luz infrarroja; luego las, las microondas y
finalmente las ondas de radio. Entre los rayos gamma y las ondas de radio
tenemos un muy amplio espectro de luz y solo una muy pequeña zona de ese
espectro es directamente perceptible a la visión.
Teoría cuántica de Planck.
Cuando
los sólidos se someten a calentamiento emiten radiación electromagnética que
abarca una amplia gama de longitudes de onda, la luz rojiza tenue de un
calentador eléctrico o la luz blanca brillante de una lámpara de tungsteno son
ejemplos de la luz que emiten los sólidos calentados.
Las
mediciones hechas en la última parte del siglo XIX mostraron que la cantidad de
energía radiante que emitía un objeto a cierta temperatura dependía de su
longitud de onda. Sin embargo, la explicación de esta dependencia con la teoría
ondulatoria establecida y con las leyes de la termodinámica no era del todo
satisfactoria. Una de las teorías explicaba la dependencia de la longitud de
onda corta pero no la de longitudes de onda más largas. Otra teoría explicaba
la dependencia de longitudes de onda larga, pero no la de las cortas. Era como
si faltara algo fundamental en las leyes de la física clásica.
Planck
resolvió el problema con una suposición que se apartaba en forma radical de los
conceptos establecidos. La física clásica asumía que los átomos y las moléculas
emitían (o absorbían) cualquier cantidad de energía radiante. En cambio, Planck
proponía que los átomos y las moléculas emitían o (o absorbían) energía solo en
cantidades discretas, como pequeños paquetes o cúmulos. A la mínima cantidad de energía que se podía
emitir (o absorber) en forma de radiación electromagnética, Planck la llamó
cuanto. La E de un solo cuanto de
energía está dada por
E = hv
Donde
h es la constante de Planck y v es la
frecuencia de la radiación. El valor de la constante de Planck es 6.63 x 10 -34
J
s.
Concepto de cuanto.
Concepto de cuanto.
Efecto Fotoeléctrico.
En 1905, solo cinco años después
de que Planck presentara su teoría cuántica, Albert Einstein la utilizó para
resolver otro misterio en la física, el efecto
fotoeléctrico, un fenómeno en el que los electrones son expulsados desde la
superficie de ciertos metales que han sido expuestos a la luz de al menos determinada frecuencia mínima, y que se
conoce como frecuencia umbral. El número de electrones liberados, no su
energía, era proporcional a la intensidad (o brillantez) de la luz. No
importaba que tan intensa fuera la luz. Los electrones no se liberaban cuando
la frecuencia no llagaba al umbral.
La teoría de la onda de luz no
podía explicar el efecto fotoeléctrico, pero Einstein partió de una
extraordinaria hipótesis al considerar que un rayo de luz es, en realidad, un
torrente de partículas. Tomando como punto la teoría cuántica de Planck,
Einstein dedujo que cada uno de estas partículas de luz, que ahora se conocen
como fotones debe poseer una energía
E, de acuerdo con la ecuación:
E = hv
Donde
es la
frecuencia de la luz.
Los electrones se mantienen
unidos en el metal por fuerzas de atracción y, para emitirlos, se necesita una
luz que tenga una frecuencia suficientemente alta.
Modelo Atómico de Rutherford.
El experimento de Rutherford, en 1911, que pretendía
comprobar la validez del modelo de atómico de Thomson, consistió en bombardear
una lámina muy fina de oro (10-3 cm de espesor) con un haz de
partículas a, cuya carga eléctrica es positiva.
En la experiencia de Rutherford los elementos radiactivos servían como “cañones de partículas”. Si se coloca una porción de material que contenga algún elemento radiactivo en una caja forrada de plomo con un orificio, dado que el plomo absorbe la radiación, casi todas las partículas que salen despedidas quedan absorbidas por el plomo, pero algunas atravesarán el agujero y formarán un delgado flujo de partículas muy energéticas que pueden dirigirse contra un blanco.
En la experiencia de Rutherford los elementos radiactivos servían como “cañones de partículas”. Si se coloca una porción de material que contenga algún elemento radiactivo en una caja forrada de plomo con un orificio, dado que el plomo absorbe la radiación, casi todas las partículas que salen despedidas quedan absorbidas por el plomo, pero algunas atravesarán el agujero y formarán un delgado flujo de partículas muy energéticas que pueden dirigirse contra un blanco.
Observa con atención el siguiente vídeo:
1. Todos los protones
y neutrones se encuentran en el centro del átomo, en el núcleo. Puesto
que la mayor parte de la masa del átomo está concentrada en esta región tan
pequeña, el núcleo del átomo tiene una densidad muy alta (1.0 x 1014 g/mL).
¡Un mililitro de materia nuclear tendría una masa de 1.1 x 108
toneladas! Asimismo, en razón de que los protones tienen carga positiva y los
neutrones son neutros, la carga relativa en el núcleo debe ser positiva e igual
a la cantidad de protones.
2.
La cantidad de protones más la cantidad de neutrones es igual al número
de masa del átomo debido a que la masa del electrón es insignificante.
3. Un átomo es eléctricamente
neutro. En un átomo neutro, la cantidad de protones
es igual a la cantidad de electrones. Si
un átomo gana o pierde electrones, se convierte en un ión. En los iones, la
cantidad de electrones no es igual a la cantidad de protones y por lo tanto
tienen cargas positiva o negativa. Los átomos son neutros, los iones tienen
carga.
4. Fuera del núcleo hay principalmente espacio vacío,
pero en este espacio se encuentran los electrones en ciertos niveles de
energía. Los niveles de energía
son una serie de áreas fuera del núcleo de un átomo en las que se localizan los
electrones.
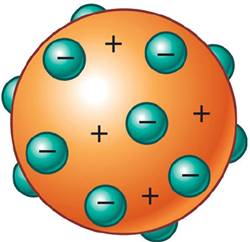
Modelo Atómico de J. J. Thomson.
Las conclusiones a las que Thomson llegó fueron las siguientes:
A las partículas de los rayos catódicos
Thomson las llamó electrones (nombre propuesto por en 1874 por J. Stoney),
palabra de origen griego que significa “ámbar” en referencia a que el primer
experimento electromagnético realizado en el mundo tuvo lugar en la antigüedad
en la ciudad de Magnesia, donde se utilizaron dos trozos de ámbar gris.
Modelo atómico de John Dalton
En 1803 John Dalton, presentó su teoría atómica con la publicación de
su New System of Chemical Philosohy. La teoría atómica de Dalton puede
definirse en los siguientes postulados:
1. Los
elementos están compuestos de pequeñas partículas separadas llamadas átomos. Esta
hipótesis ha sido comprobada de manera experimental. Los átomos individuales de
diversos elementos han sido fotografiados con un microscopio electrónico de
barrido.
2. Los átomos
son indivisibles e indestructibles y conservan su identidad a través de los
cambios físicos y químicos. La investigación moderna ha modificado esta
hipótesis. Los átomos ya no son indestructibles y pueden perder su identidad
cuando se dividen durante las reacciones nucleares. Sin embargo, la hipótesis
de Dalton sigue siendo cierta para reacciones químicas.
3. Los átomos
de un mismo elemento son idénticos en masa y tienen las mismas propiedades
químicas y físicas. Los átomos de diferentes elementos tienen diferentes
masas y difieren en sus propiedades físicas y químicas. No obstante, los átomos
de un mismo elemento (denominados isotopos) pueden tener diferentes masas.
4. Cuando los
átomos de los elementos se combinan para formar moléculas de compuestos lo hacen
siempre en proporciones de números enteros. Por ejemplo, los átomos se
pueden combinar en proporciones de 1:1, 1:2 o 2:3. Este principio ha sido
confirmado de manera experimental.
5. Los átomos de diferentes elementos pueden unirse en diferentes proporciones
para formar más de un compuesto. Éste es otro principio demostrado
experimentalmente En la imagen anterior, dos átomos de hidrógeno se unieron con
un átomo de oxígeno para forma agua (H2O). Dos átomos de hidrógeno
también se pueden combinar con dos átomos de oxígeno para formar una molécula
de peróxido de hidrógeno (H2O2).
Lógicamente
el modelo y la teoría inicial de Dalton han sido modificados y algunas de sus
partes han sido descartadas a medida que se han ido acumulando millares de
nuevos hechos químicos. No obstante, los aspectos principales del modelo y la
teoría de Dalton son todavía útiles y válidos.
Modelo Atómico de Democrito y Leucipo
 Alrededor del año 400 a. C; los filósofos
griegos Demócrito y Leucipo fueron los primeros en
introducir la palabra átomo, que se refería a una porción indivisible de
la materia. Cuando se divide un pedazo de madera –argumenta Demócrito–, es
lógico pensar que la hoja del cuchillo penetra en intersticios existentes en la
materia. Las partículas últimas indivisibles de la materia son los átomos. Cada
uno de estos átomos eternos, indestructibles y eternamente invariables,
representa una unidad parmenidiana (de Parménides). Los átomos no poseen sabor,
olor, no color; todas estas propiedades no residen en la materia. Todas las
cosas se componían de átomos. Resumiendo la filosofía atómica antigua;
Alrededor del año 400 a. C; los filósofos
griegos Demócrito y Leucipo fueron los primeros en
introducir la palabra átomo, que se refería a una porción indivisible de
la materia. Cuando se divide un pedazo de madera –argumenta Demócrito–, es
lógico pensar que la hoja del cuchillo penetra en intersticios existentes en la
materia. Las partículas últimas indivisibles de la materia son los átomos. Cada
uno de estos átomos eternos, indestructibles y eternamente invariables,
representa una unidad parmenidiana (de Parménides). Los átomos no poseen sabor,
olor, no color; todas estas propiedades no residen en la materia. Todas las
cosas se componían de átomos. Resumiendo la filosofía atómica antigua;- Todas las cosas están hechas de átomos sólidos.
- Espacio o vacío, es decir, vacuidad, existe entre los átomos.
- Los átomos son eternos.
- Los átomos, por ser demasiado pequeños no son visibles.
- Los átomos son indivisibles, homogéneos e incomprensibles.
- Los átomos difieren uno de otro por su forma, tamaño, distribución geométrica.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
domingo, 13 de marzo de 2016
Introducción a los modelos atómicos.
Introducción
Desde
la antigüedad, los hombres se han preguntado de qué están hechas las cosas. El
primero del que tenemos noticias fue un pensador griego, Tales de Mileto, quien en el siglo VII antes de Cristo, afirmó que
todo estaba constituido a partir de agua, que enrareciéndose o solidificándose
formaba todas las sustancias conocidas. Con posterioridad, otros pensadores
griegos supusieron que la sustancia primigenia era otra. Así, Anaxímenes de Mileto, en al siglo VI a.
C. creía que era el aire y Heráclito de
Éfeso, el fuego.
En el siglo V, Empédocles de Agrigento reunió las teorías de sus predecesores y
propuso no una, sino cuatro sustancias primordiales, los cuatro elementos: aire,
agua, tierra y fuego. La unión de estos cuatro elementos, en distinta
proporción, daba lugar a la vasta variedad de sustancias distintas que se
presentan en la naturaleza. Aristóteles,
añadió a estos cuatro elementos un quinto: el quinto elemento, el éter o quinta
esencia, que formaba las estrellas, mientras que los otros cuatro formaban las
sustancias terrestres.
Suscribirse a:
Comentarios (Atom)