Antecedentes del modelo atómico de Bohr.
Energía Radiante.
Para comprender la teoría cuántica de Planck
es necesario tener cierto conocimiento acerca de la naturaleza de las ondas.
Podemos pensar en una onda como una alteración vibrátil mediante la cual se
transmite la energía. Las propiedades básicas de una onda se ilustran con un
tipo muy conocido de ondas: las del agua. La variación regular de las crestas y
los valles hace posible percibir la propagación de las ondas.
Las propiedades características
de las ondas son su longitud y altura, así como el número de andas que pasan
por determinado punto en un segundo. La longitud
de onda
(lambda) es
la longitud entre puntos iguales de ondas sucesivas. La frecuencia
(nu), es el número de ondas que pasan por un
punto particular en un segundo. La amplitud de la onda es la longitud
vertical de la línea media de una onda a su cresta o a su valle. La rapidez es
otra de las propiedades importantes de una onda, que depende del tipo de onda y
del medio en el cual viaja (por ejemplo, agua, aire o vacío). La rapidez (u) de
una onda es el producto de su longitud y frecuencia:
Existen
muchos tipos ondas, como las del agua, del sonido y de la luz, en 1873, James
Clerk Maxwell propuso que la luz visible se compone de ondas electromagnéticas.
De acuerdo con esta teoría, una onda electromagnética tiene un componente de
campo eléctrico y un componente de campo magnético. Ambos tienen la misma
longitud de onda y frecuencia, y por tanto, igual rapidez, pero viajan en
planos perpendiculares entre sí. La trascendencia de la teoría de Maxwell
estriba en que aporta una descripción matemática del comportamiento general de
la luz. En particular, el modelo de Maxwell describe con exactitud cómo se
puede propagar la energía en forma de radiación a través del espacio como una
vibración de campo magnético y eléctrico. La radiación electromagnética es
la emisión y transmisión de energía
en forma de ondas electromagnéticas.
Las ondas electromagnéticas
viajan a 3.00 x 10 8 metros por segundo. Esta rapidez varía según el
medio, pero no lo suficiente para modificar de manera sustancial los cálculos.
Por convención, la rapidez de las ondas electromagnéticas, que comúnmente se
llama rapidez de la luz, se expresa con el símbolo c. la longitud de onda de las ondas electromagnéticas se expresa
normalmente en nanómetros (nm).
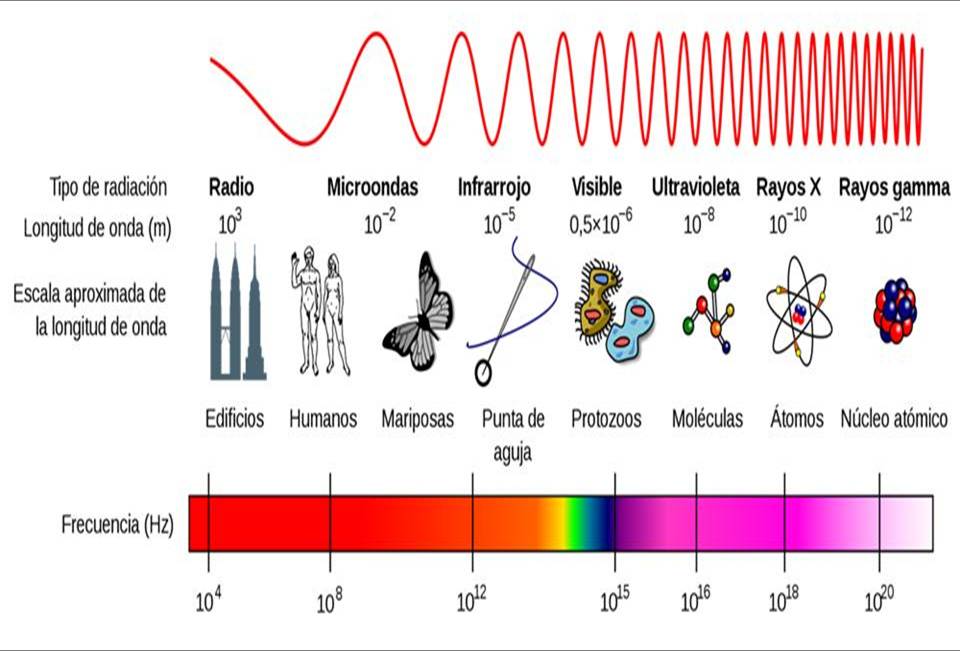
A continuación presentamos los distintos rangos de fotones que contiene
el espectro electromagnético: Los fotones con más energía que se conocen son
los Fotones gamma, son aquellos
asociados a las longitudes de onda más corta y son llamados rayos gamma. Si se
sigue incrementando la longitud de onda, continúan los rayos x, y luego los
rayos ultravioleta.
Si seguimos aumentando la
longitud de onda pasamos a la luz infrarroja; luego las, las microondas y
finalmente las ondas de radio. Entre los rayos gamma y las ondas de radio
tenemos un muy amplio espectro de luz y solo una muy pequeña zona de ese
espectro es directamente perceptible a la visión.
Teoría cuántica de Planck.
Cuando
los sólidos se someten a calentamiento emiten radiación electromagnética que
abarca una amplia gama de longitudes de onda, la luz rojiza tenue de un
calentador eléctrico o la luz blanca brillante de una lámpara de tungsteno son
ejemplos de la luz que emiten los sólidos calentados.
Las
mediciones hechas en la última parte del siglo XIX mostraron que la cantidad de
energía radiante que emitía un objeto a cierta temperatura dependía de su
longitud de onda. Sin embargo, la explicación de esta dependencia con la teoría
ondulatoria establecida y con las leyes de la termodinámica no era del todo
satisfactoria. Una de las teorías explicaba la dependencia de la longitud de
onda corta pero no la de longitudes de onda más largas. Otra teoría explicaba
la dependencia de longitudes de onda larga, pero no la de las cortas. Era como
si faltara algo fundamental en las leyes de la física clásica.
Planck
resolvió el problema con una suposición que se apartaba en forma radical de los
conceptos establecidos. La física clásica asumía que los átomos y las moléculas
emitían (o absorbían) cualquier cantidad de energía radiante. En cambio, Planck
proponía que los átomos y las moléculas emitían o (o absorbían) energía solo en
cantidades discretas, como pequeños paquetes o cúmulos. A la mínima cantidad de energía que se podía
emitir (o absorber) en forma de radiación electromagnética, Planck la llamó
cuanto. La E de un solo cuanto de
energía está dada por
E = hv
Donde
h es la constante de Planck y v es la
frecuencia de la radiación. El valor de la constante de Planck es 6.63 x 10 -34
J
s.
Concepto de cuanto.
Concepto de cuanto.
Efecto Fotoeléctrico.
En 1905, solo cinco años después
de que Planck presentara su teoría cuántica, Albert Einstein la utilizó para
resolver otro misterio en la física, el efecto
fotoeléctrico, un fenómeno en el que los electrones son expulsados desde la
superficie de ciertos metales que han sido expuestos a la luz de al menos determinada frecuencia mínima, y que se
conoce como frecuencia umbral. El número de electrones liberados, no su
energía, era proporcional a la intensidad (o brillantez) de la luz. No
importaba que tan intensa fuera la luz. Los electrones no se liberaban cuando
la frecuencia no llagaba al umbral.
La teoría de la onda de luz no
podía explicar el efecto fotoeléctrico, pero Einstein partió de una
extraordinaria hipótesis al considerar que un rayo de luz es, en realidad, un
torrente de partículas. Tomando como punto la teoría cuántica de Planck,
Einstein dedujo que cada uno de estas partículas de luz, que ahora se conocen
como fotones debe poseer una energía
E, de acuerdo con la ecuación:
E = hv
Donde
es la
frecuencia de la luz.
Los electrones se mantienen
unidos en el metal por fuerzas de atracción y, para emitirlos, se necesita una
luz que tenga una frecuencia suficientemente alta.

No hay comentarios:
Publicar un comentario